近日,长春长生生物科技有限责任公司生产的狂犬疫苗和百白破疫苗存在严重质量问题遭立案调查。此后,“疫苗门”事件不断发酵。
7月22日,凤凰网财经实地走访了长生生物位于长春的厂区,发现场内人去楼空,大部分车间停工,药监局车辆自上午就已经进入厂区。
凤凰网财经联系到多位此前因接种长生生物疫苗致病患儿家属,有儿童接种长生生物疫苗后患有脓毒血症、重症肺炎并双侧胸腔积液、全身多发软组织感染等多项疾病,花费百万。目前已经有40多位接种异常儿童家长联合签名,想约共同维权。
今日,国家药监局宣布会同吉林省局已对企业立案调查,涉嫌犯罪的移送公安机关追究刑事责任。负责人称,这是该企业一年内被第二次发现产品生产质量问题。
有律师表示,如果确定长生生物信息披露违规,不排除被强制退市。
厂内人去楼空药监局公务车进入厂区
今日,凤凰网财经实地走访发现,长生生物位于长春的厂区内所有生厂车间均已停工。正值周末,公司内部几乎没有行人。一位自称在公司工作10年的后勤人员告诉凤凰网财经,以往公司周末也需要加班,但自从疫苗问题爆出后,所有疫苗的生产线都已停工,绝大部分员工在家等待通知。
7月15日,国家药品监督管理局发布通告称,药监局检查组在对长生生物疫苗生产现场进行飞行检查时发现,长生生物在冻干人用狂犬病疫苗生产过程中存在记录造假。除狂犬病疫苗外,2018年7月20日吉林省药监局发布行政处罚,经中国食品药品检定研究院检验,长生生物生产的“吸附无细胞白百破联合疫苗”【效价测定】项不符合规定,按劣药论处。
凤凰网财经在公司现场看到,长生生物拥有约十几栋楼,一位负责生产质量的员工描述道,这些楼内分布着不同的疫苗生产线。
尽管生产陷入停顿,公司的一些重要设备仍在正常工作,整个厂区都可以听到机器运转的轰鸣声。上述后勤人员表示,自药监局介入、公司停工后,这些设备并都没有停止工作,“这是为了保证机器不坏。”
紧邻长生生物公司的南侧有一处工地,约半个操场大小。在这处工地上,一栋楼房即将完工,楼下堆积着大量储物箱,箱子上贴着长生公司的标签,一些箱子里装着金属管件。一位工地的工友表示,目前正在往工地运送药品制造设备。
楼下一块布告牌上写着工作安排,显示设备安装的施工主体单位是上海意迪尔公司,目前的工作主要集中在管道安装。这栋楼的主体有3层高,凤凰网财经进入楼内,发现每层除了隔板以外,几乎空无一物,重要设备还没有上马。
据悉,这个项目的建设时间是2017年4月到2018年10月,计划总投资7.5亿元。项目完工后,将成为长生公司水痘疫苗、狂犬疫苗的技改生厂车间。上述后勤人员告诉凤凰网财经,之所以要建造这座新车间,是因为老车间年代已久,跟不上GMP标准。

图:目前公司在用的部分疫苗车间已经老旧。这个工地完工后,长生公司将拥有一个全新车间,以生产水痘、狂犬疫苗。
目前,长生生物的GMP证书已经国家药监局收回,长生生物已按要求停止狂犬疫苗的生产,正对所有狂犬病疫苗(vero细胞)实施召回。7月18日,长生生物公告称,该项召回预计将减少公司2018年上半年营业收入约2亿元左右,净利润约1.4亿元,预计将减少2018年下半年营业收入约5.4亿元左右。
但凤凰网财经注意到,这座将用于生产狂犬病疫苗的新车间仍然在正常施工建设。

图:即将完工的水痘、狂犬疫苗的新车间
据悉,疫苗问题爆出后,长生公司的安保升级。凤凰网财经在厂区内逛了一段时间后,得知消息的门卫赶来,要求凤凰网财经离开公司,原路返回。凤凰网财经提出从正门离开,被门卫拒绝。“要是被领导知道了,我们也得挨批评。”
在离开厂区前,凤凰网财经在停车场上看见了药监局的公务车。这辆车大概是今天上午11点进入长生公司的。

图:上午11点15分,药监局的公务车进入长生公司
有儿童接种长生生物疫苗异常花费已超百万
凤凰网财经调查发现,此前已有接种长生生物疫苗致病问题
2015年10月22日,李霞带着仅10个月大的孩子瑞瑞,来到山东省交通医院接种百白破疫苗。此前,李霞7岁的大儿子出生后已接种过25支疫苗,均未出现异常反应。
但李霞没有想到的是,这次瑞瑞接种百白破疫苗会从此改变一家人的生活。
李霞告诉凤凰网财经,10月22日上午,瑞瑞在交通医院接种长生生物生产的百白破疫苗(批次为20141027-02)后,从下午开始出现发烧现象,并且哭闹不止。李霞立即给交通医院拨打电话,医生称发烧是注射疫苗后的正常情况,并无大碍,只是建议让瑞瑞多喝水。
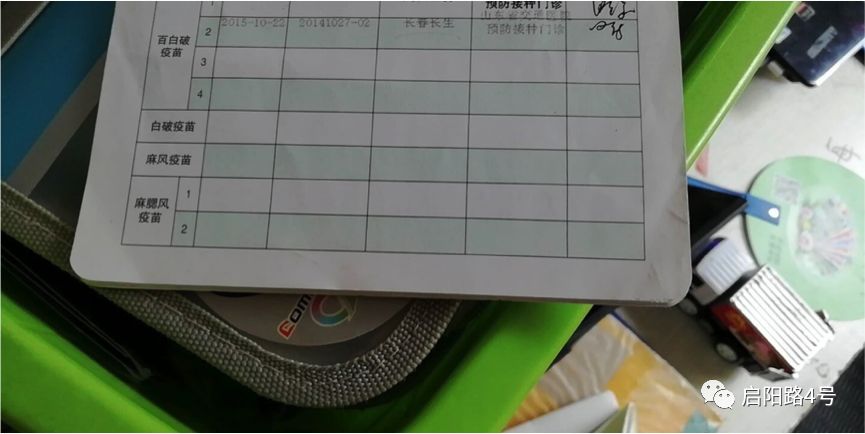
图:李霞向凤凰网财经出示的孩子接种疫苗记录
但瑞瑞的情况始终不见好转。第二天,李霞带着瑞瑞再次来到交通医院,询问前一天接诊的医生。医生给瑞瑞开了抗病毒药物,但瑞瑞始终高烧39度,并且开始有出疹现象。
焦急又无奈的李霞以为孩子得了皮肤病,带着瑞瑞找到济南一家医院的皮肤科专家,专家表示瑞瑞的病情并不是简单的皮肤病,建议李霞尽快带孩子去看儿科。
于是,李霞和瑞瑞又来到山东省中医院。瑞瑞在中医院住院2天,但病情继续加重。李霞带着哭腔告诉凤凰网财经,当时瑞瑞全身发肿,衣服都穿不上去,高烧始终不退。最终,李霞不顾中医院继续住院的要求,带着瑞瑞转去儿童医院。
在儿童医院,瑞瑞很快被送进重症监护室。经检查,瑞瑞已患有脓毒血症、重症肺炎并双侧胸腔积液、全身多发软组织感染等多项疾病。
原本李霞是医院的一名护士,其丈夫在做生意。瑞瑞生病后,李霞和丈夫停下了原本的生活,开始带着孩子在北京、上海的多家医院就医。目前,已经3岁4个月大的瑞瑞,病情基本得到控制,但右手软骨因受损无法拿东西,膝关节也有损失需要持续用药。
李霞说,现在每两个月就要带着瑞瑞住院接受生物制剂治疗,每次的住院费和药费至少需要两万五千元。谈到这些费用,李霞已经不觉得沉重,因为此前在外地带孩子看病,家里已经花掉了一百多万元,债台高筑。
李霞也曾找过当时接种疫苗的交通医院。李霞告诉凤凰网财经,医院的态度比较好,“承认是在他们那儿出的事,上报给了疾控中心”。
2017年8月24日,济南医学会对瑞瑞的病情开具《预防接种异常反应鉴定书》。鉴定书中显示,“根据病史、查体和现有材料综合分析结果,符合预防接种异常反应,与接种疫苗有关。”并且参照《医疗事故分级标准》,确定瑞瑞损害程度为II级乙等,补偿年限为二十二年。

图:李霞向凤凰网提供的鉴定书照片
李霞称,此后分别获得了疾控中心提供的70多万和30万的赔偿金。
2016年时,李霞和丈夫曾一度实在拿不出钱继续给瑞瑞治病。在一位朋友的建议下,李霞找到一个疫苗受害者的交流群。凤凰网财经在群里看到,像瑞瑞这样的情况还有很多。其中有不少家长的孩子,也曾因为接种长生生物的疫苗出现异常反应,致病致残,甚至有孩子因接种疫苗死亡。
近日,长生生物的狂犬疫苗和百白破疫苗被曝出造假丑闻后,受害人家长的交流群也再次热闹起来。目前,已有四十多个家长参与联名签字,计划到北京讨要说法。
海南文昌的房斌也在联名签字中留下了自己的名字。他向凤凰网财经出示的《预防接种异常反应调查诊断书》显示,2014年8月16日,房斌4岁的孩子凯凯在玩耍时不慎被狗抓伤头部,当天在文昌市洒镇卫生院就诊,并接种长生生物批次为20130917的冻干人用狂犬病疫苗,在2014年8月16日至30日期间共接种四针狂犬病疫苗。

图:房斌向凤凰网财经提供的接种疫苗证明
房斌回忆,凯凯在接种第二针时开始出现发烧、咳嗽、呕吐和腹痛现象,此后病情不断加重。经诊断凯凯患上急性播散性脑炎、脑性瘫痪(四肢痉挛症)和继发性癫痫。
诊断书中的调查结论是,“患儿所患疾病与接种动干人用狂犬病疫苗(Vero细胞)有因果关系。”

图:房斌向凤凰网财经提供的鉴定书照片
房斌说,这四年来凯凯一直都躺在床上,“最可恨的是,小孩当时很需要钱康复,当时厂家一直赖皮拖着不补偿。”最终,省卫生厅出面要求厂家向房斌一次性赔偿了90多万元。
对于为什么家长们更愿意选择上访或私下和解,而不是通过司法程序维权,李霞向凤凰网财经表示,“如果打官司就把孩子的路堵死了,打赢了也赔不了多少钱,之前有人走过司法程序,就赔偿了二三十万。”
李霞说,现在选择和大家一起维权,是“为了孩子后续也能得到保障,不是拿一些钱就完了。过几年其他疫苗也可能出事,总不能每次出事就多一些像我们这样的父母。我就是想给孩子讨个公道,也让这些企业认识到问题的重要性。”
章李律师接受凤凰网财经的采访时表示,在患者权益受到侵犯的医疗损害责任纠纷中,患者可以同时起诉医院和厂家承担民事责任。
对于在李霞和房斌的案例中,鉴定诊断书中确认孩子所患疾病与接种疫苗有关,章李认为,这一诊断是非常有利于家属维权的证据。章李介绍道,此类维权面临的最大困难之处在于,一些鉴定书中将孩子出现的异常情况认定为偶发事件,非常不利于患者获得赔偿。
而对于此次长生生物被曝出的疫苗造假问题,章李分析,如果国家药监局最终的调查结果证明长生生物的疫苗存在质量问题,长生生物及其负责人将因生产销售假药劣药罪面临检察院的公诉和国家药监局的行政处罚。但从目前情况来看,调查仅涉及存在问题的两个批次疫苗,不包括此前因接种长生生物其他批次疫苗引起的患者受害情况。
国汉律师事务所的律师助理宋怀淇则在凤凰网财经咨询时介绍道,对于接种疫苗致病的患者维权,无论疫苗本身是否合格,患者都可以直接向医院追责,由医院再向厂家追责,患者没有义务自己联系药厂。
对于生产假药的公司,公安部门会进行调查和证据搜集,此后由检察院向公司提起公诉,受害者家属也可以同时起诉药厂要求其承担附带民事赔偿。
长生生物的“造假门”事件近日不断发酵,也牵出更多疫苗生产、销售和使用环节存在的问题和猫腻。不仅是长生生物生产的疫苗存在质量问题,原国家食品药品监管总局官网在2017年11月3日发布的信息显示,武汉生物制品研究所有限责任公司生产的批号为201607050-2的百白破疫苗,效价指标也不符合标准规定。
在凤凰网财经调查期间,除李霞和房斌外,也有多个患儿的家属向凤凰网财经反映情况。这些家长来自全国不同地区,孩子在不同时间,因注射不同类型、批次的疫苗致病致残。
此前,房斌一直怀疑孩子生病与疫苗的质量问题有关。近日长生生物的疫苗质量问题被曝光后,房斌更加气愤不已。
目前,这些受害患儿的家长决定自我组织起来到北京维权。对于此行的意义和具体安排,李霞坦承“来北京的事还没完全定下来,但是我们肯定会去。受害者不站出来,谁站出来,总不能让孩子二十年以后自己去维权。”
药监局抽检范围一般不大如何防止疫苗之殇?
如何防止疫苗之殇?各个环节之间如何运转的?山东菏泽药监局工作人员张丽(化名)告诉凤凰网财经,一般生产疫苗企业在生产期间,药监局会定期抽查,看各个生产数据、指标是否达标。
此次长生生物疫苗造假问题就在其生产期间药监局检查组在对长春长生疫苗生产现场进行飞行检查时发现,长春长生在冻干人用狂犬病疫苗生产过程中存在记录造假。
对于此次长生生物疫苗造假事件,知名疫苗专家陶黎纳透露道,“说造假有点严重了,实际上应该说是长生生物擅自改变生产工艺,而这种擅自改变工艺未必必然改变安全和效果上的问题。这是工艺上的造假,但是具体会导致结果会怎么样不可而知。”
陶黎纳还向凤凰网财经透露了具体工艺造假细节,“主要是擅自把大罐替代了小罐。为了提高产量,他把原本用小罐来装细胞的培养器皿,擅自改用了大罐。好比,大碗盛饭和小碗盛饭。普通人看来,小碗和大碗没有本质性区别,但是实际上对于微生物来讲,一个小的环境和一个大的环境有可能改变微生物的代谢,改变代谢以后就有可能生成新的物质,这种物质在原来的检测流程里面是没有考虑过,这可能带来隐患,比如像牛奶里面添加三聚氰氨,原来牛奶的检测体系是不检测三聚氰氨。”
陶黎纳介绍,每一批生产出来的疫苗,中国食品药品检定研究院(以下简称:中检院)对每个批次的疫苗会进行安全和效果检测,检测合格会发一个批签发合格证书。
“批签发对安全性指标和效果指标是区分对待的,安全性指标是所有每一批生产出来的疫苗都要再做安全性检测,有效性指标是抽检,对于国产疫苗大概是抽10%的比例,进口疫苗百分之百进行抽检”,陶黎纳说道。
“疫苗取得了批签发证书后才可以销往各省疾病防控中心。在运输过程中,运输温度也要有一定控制,大概每隔4个小时左右会做一个温度记录。到达目的地后,接受的人要索取温度检测记录”,山东菏泽药监局工作人员张丽。
张丽介绍,2016年之前地方疾控中心可以从其他渠道自采疫苗,2016年震惊全国的山东非法销售疫苗案后,所有疫苗获得渠道都由山东省集中统一采购,然后再分发到各地市,各地市再往县里一级一级边分发。
2016年4月13日国务院总理李克强主持召开的国务院常务会议还讨论并原则通过了《国务院关于修改〈疫苗流通和预防接种管理条例〉的决定(草案)》,并于4月25日公布并施行。针对案件暴露出的第二类疫苗流通链条长、牟利空间大等问题,《决定》删除了《条例》关于药品批发企业经批准可以经营疫苗的条款,规定“第二类疫苗由省级疾病预防控制机构组织在省级公共资源交易平台集中采购,由县级疾病预防控制机构向疫苗生产企业采购后供应给本行政区域的接种单位。”不再允许药品批发企业经营疫苗。
张丽介绍,各省疾控中心会制定疫苗抽检计划和数量计划,数量计划是由地方卫生部门统计后逐级上报到省卫生部门,而疫苗而疫苗抽检计划是由省疾控制定逐级下发到地方,地方按照抽检计划进行抽检。
“我们会对储存的温度、疫苗渠道、有效期、运输记录等进行定期抽检,”张丽表示。不过,她也指出一般抽检范围都不大,因为这个经过了中检院各方面的检测,出于人力、物力、财力等成本的考虑,我们不会进行逐批次检测,还是按照省疾控的计划书进行检测,“经费在那儿,又有很多品种,每批都检查不可能。而且主要国家的中检院权威机构都已经做过检测了,就没必要花太多成本去做这个事情。”
陶黎纳对此也补充道,“2005年,我们开始建立疫苗安全性体系。疫苗上市接种后,如果有不良反应会在一个网络系统里报告。中国疾控中心会有实时的数据反馈,如果发现问题会及时处置。目前整个安全管理机制是非常完善的。”
他提到,世界卫生组织给中国的疫苗监管水平评分很高,四次评价中前两次我们没合格,后面两次都是高分通过,我也参与其中了。
而对于此次曝光的涉事疫苗,张丽表示,“目前,山东菏泽没有孩子接种被曝出不合格批次的长生生物百白破疫苗。”
继狂犬疫苗造假事件后,长生生物7月18日又发布了来自吉林食药局的处罚公告,长生生物全资子公司长春长生生物科技有限责任公司(以下简称“长春长生”)公司生产的“吸附无细胞百白破联合疫苗”,经中国食品药品检定研究院检验,检验结果“效价测定”项不符合规定。
经查明,该批药品生产数量共253338支,由吉林省药品检验所抽样552支,销售到山东省疾病预防控制中心252600支,现库存186支,销售价格是3.40元/支,该批药品的违法所得共858840.00元,货值金额共861349.20元。
凤凰网财经查阅资料发现,早在2017年11月3日,食药局官网就通报了此次疫苗不合规事件,而涉事企业不止长生生物一家。食药局官网显示,总局近日接到中国食品药品检定研究院(以下简称:中检院)报告,在药品抽样检验中检出长春长生生物科技有限公司生产的批号为201605014-01、武汉生物制品研究所有限责任公司(简称:武汉生物)生产的批号为201607050-2的百白破疫苗效价指标不符合标准规定。
经查,长春长生生物科技有限公司生产的该批次疫苗共计252600支,全部销往山东省疾病预防控制中心;武汉生物制品研究所有限责任公司生产该批次疫苗共计400520支,销往重庆市疾病预防控制中心190520支,销往河北省疾病预防控制中心210000支。
不过当时食药局发言人表示,该2批次百白破疫苗效价指标不合格,可能影响免疫保护效果,但是对人体安全性没有影响。
陶黎纳认为,效价问题方面,目前是对国产疫苗批签发抽检10%,进口疫苗是100%检测。将来是否需要提高国产疫苗抽检比例,需要通盘考虑。因为抽检比例高了,疫苗上市的周期必定延长,是否可能导致疫苗供应短缺,需要仔细评估。另外,还需要从经济学角度分析这种提高抽检比例是否性价比高。
不过对于这两批次产品不合规原因等问题,当时官方表态需6至8周作出结论。时至今日,并未有任何结论和补救措施。
除了送到国家指定检测机构检测的情况,陶黎纳提到,其实不能忽视厂家自检。长春长生和武汉生物的不合格白百破疫苗在厂家自检时是否被发现,这个需要调查部门进一步披露。如果确实自检水平有问题,这应该在全行业加强培训和质控,达到某种标准才行。
而值得玩味的是,长春长生狂苗数据造假事件曝光后,吉林省食药监管理局才迅速对该公司去年的白百破疫苗不合格事件做出了三项处罚决定,没收库存的白百破疫苗186支;没收违法所得86万元;处三倍罚款258万元。
而对于另一家公司的武汉生物的处罚,目前公开资料显示并未有任何消息。
陶黎纳表示,对于白百破疫苗不合格事件的处理应该分为两层,第一层是通过惩罚以及修改相关管理/技术规范,最大程度减少这类事件再发生的概率;第二层是要给公众,特别是已种不合格疫苗的孩子家长们一个明确交代。所谓明确交代,就是:到底要不要补种?如果要补种,需要补种几剂?
“现在8个月过去了,对不合格疫苗的行政处罚刚刚实施,那么下一步是否就应该给家长们一个明确的交代呢?”陶黎纳表示。
7月22日,长生生物销售总监杨鸣雯对媒体表示,问题疫苗流向的山东省已经出台了补种方案,即将陆续实行。不过,凤凰网财经就此致电山东省疾控中心,电话并未接通。
对于官方的处罚措施,陶黎纳认为“处罚过轻”,“国家承诺要给出一个调查结果给公众,迟迟未交代,此外,后续是否需要补种也应该给个明确说法。而对于企业的处罚,百白破的事故应该不是故意为之,可能是能力有限导致出了纰漏,但是罚的力度还是不够。但这次造假却是故意为之,至少要吊销生产狂犬病疫苗的许可证,现在只是说收回,没有说吊销。此外,对责任人要上刑,依据生产假药罪,按最重标准量刑。”
对于此次事件的影响,陶黎纳解释道,这次狂苗数据造假,是生产工艺发生重大变更而没有按规定申报获批。这个变更主观上是为了提高产量,但客观上可能因为蝴蝶效应而带来意想不到的负面影响。但是,就本次事件而言,我认为不至于对疫苗效果和公众健康造成实质性影响。
针对狂犬疫苗问题,陶黎纳还建议,狂犬病毒的防治应从动物身上着手,而不是人,“应该给动物打疫苗,而不是人,现在发达国家多数采取的这种措施防治狂犬病。世界范围来看,现在造成狂犬病的因素99%来自狗,只要把狗控制好就没事了,中国现在也具备了这种能力。但目前,给狗打的疫苗多是活病毒疫苗,而这个活病毒反而有可能会引起狂犬病。而现在人用的狂犬病疫苗质量很好,很有把握用在狗身上没问题。但现在狗用疫苗好像由农业部在管,人用疫苗是卫健委在管,两块体制还没打通。”
凤凰网财经就此致电国家药监局、中检院、山东疾病防控中心、山东药监局和吉林药监局等监管部门,均未得到回复。
一位不愿意具名的医药界人士告诉凤凰网财经,要想杜绝疫苗之殇,需要打通现有的监管机制,协调监管,并发挥社会力量参与,让疫苗企业不敢也不能造假。
药监局启动立案调查公司称“十分的自责和愧疚”
国家药监局负责人今天通报长春长生生物科技有限责任公司违法违规生产冻干人用狂犬病疫苗案件有关情况。现已查明,企业编造生产记录和产品检验记录,随意变更工艺参数和设备。
国家药监局表示,上述行为严重违反了《中华人民共和国药品管理法》《药品生产质量管理规范》有关规定,国家药监局已责令企业停止生产,收回药品GMP证书,召回尚未使用的狂犬病疫苗。国家药监局会同吉林省局已对企业立案调查,涉嫌犯罪的移送公安机关追究刑事责任。负责人说,该企业是一年内被第二次发现产品生产质量问题。
今日下午,长生生物发布对深交所2017年年报问询函的回复更正公告称,由于工作人员疏忽,将近三年公司各产品批签发数量统计表中冻干人用狂犬病疫苗2016年、2017年批签发量统计错误。
公司2016年冻干人用狂犬病疫苗批签发量原来为1755210人份,修正为2072719人份;2017年冻干人用狂犬病疫苗批签发量原来为3545716人份,修正为3690750人份。凤凰网财经计算发现,长生生物冻干人用狂犬病疫苗两年合计增加462543人份。
截至公告披露日,虽然冻干人用狂犬病疫苗、百白破联合疫苗均已停产,但长生生物水痘疫苗仍在销售,同时公司已取得四价流感病毒裂解疫苗药品注册批件、新药证书及GMP 证书,处于正常生产经营中。2017年公司水痘疫苗实现销售收入5.72 亿元,占公司2017 年度营业收入的37%。
截至公告披露日,仅有包括公司在内的两家公司取得四价流感病毒裂解疫苗的生产许可,市场竞争格局良好。从目前情况看,考虑到水痘疫苗和四价流感病毒裂解疫苗的经营,我们认为尚不构成《深圳证券交易所股票上市规则(2018 年修订)》第13.3.1 条第一款规定的情形。
长生生物表示,因狂犬疫苗是否能够复产以及准确的复产时间无法准确预计,此次冻干人用狂犬病疫苗(vero 细胞)停产除对本年度财务产生较大负面影响外,对长生生物未来经营的影响程度存在重大不确定性。由于受到狂犬疫苗事件影响,预计对其他产品销售也将带来负面影响,但目前尚无法准确预计。根据目前了解的情况,有部分地区疾控机构暂时停用公司其他疫苗产品。公司所有已经上市的人用狂犬病疫苗产品均经过自检,质量符合国家注册标准。按照《生物制品批签发管理办法》的规定,在取得中国食品药品检定
“对于此次事件的发生,我们感到十分的自责和愧疚,再次向各位接种者和投资者表示深深的歉意。公司将引以为戒,举一反三,制定切实可行的纠正措施,进行彻底整改,进一步提升企业生产质量管理水平和能力,加强风险管理,严格执行疫苗生产各项操作规范,确保生产的合规性、真实性、可靠性、可追溯性以及疫苗质量的安全性。”长生生物称,公司将密切跟踪事件进展,积极配合国家药品监督管理局、吉林省食品药品监督管理局等相关监管部门开展后续工作。
章李律师表示,根据《关于改革完善并严格实施上市公司退市制度的若干意见》,强制退市主要是针对虚假披露信息情节严重在行政处罚决定书中被认定构成重大违法行为,或者因涉嫌违规披露、不披露重要信息罪被依法移送公安机关的,证券交易所应该暂停其股票上市交易,并在一年内作出终止其股票上市的决定。“如果确认长生生物信息披露违规,不排除被强制退市。”章李表示。
(为保护受害者家属个人隐私,文章中姓名均为化名)


